ENUNCIADOS DEL SEGUNDO PRINCIPIO
Y SU EQUIVALENCIA
IRREVERSIBILIDAD Y REVERSIBILIDAD
El segundo principio nos permite demostrar la irreversibilidad
de los procesos naturales.
Muchos procesos naturales tienen lugar por falta de equilibrio
mecánico. Un ejemplo típico de esta clase de procesos
es la expansión libre de un gas perfecto. Cuando decimos
que este proceso es irreversible, queremos decir que el proceso
inverso queremos decir que el proceso inverso no puede tener lugar
espontáneamente (sin modificaciones en otros sistemas).
El gas puede volver a su estado inicial realizando sobre él
un trabajo de compresión en contacto con un foco pero,
en tales circunstancias tienen lugar dos cambios en los sistema
externos: un peso ha descendido y un trabajo equivalente ha pasado
al foco en forma de calor.
Para que la inversión del proceso de expansión libre
sea posible sin influencias externas es necesario que el calor
del foco se convierta en trabajo sin otros cambios, pero esto
no es posible de acuerdo con el enunciado de Kelvin – Plank.
Por lo tanto, no es posible invertir el proceso sin otros cambios
y decimos entonces que es irreversible. En el ejemplo queda claro
que la irreversibilidad no implica la imposibilidad de volver
a la situación inicial sino, únicamente, la imposibilidad
de transformación espontánea.
La falta de equilibrio térmico entre dos sistemas da lugar
al proceso espontaneo de paso de calor desde el cuerpo de mayor
temperatura al de más baja, hasta que se alcanza el equilibrio
térmico. No es posible volver al estado inicial sin otros
cambios pues ello iría en contradicción con el enunciado
de Clausius. El proceso inverso no podrá realizarse espontáneamente
lo que implica que el proceso de paso de calor de un cuerpo caliente
a uno frio es un proceso irreversible.
Por falta de equilibrio químico tienen lugar procesos tales
como reacciones químicas, mezclas, etc. No es fácil
demostrar la irreversibilidad de tales procesos mediante el segundo
principio; no obstante, admitiremos su irreversibilidad puesto
que nunca se ha observado una inversión espontánea
de tales procesos.
Finalmente podemos considerar los efectos disipativos provocados
por la conversión de trabajo en calor debido al rozamiento,
viscosidad, resistencia eléctrica, etc., que son también
irreversibles. Así, por ejemplo, si se tiene una resistencia
por la que pasa una corriente y se encuentra en contacto con un
foco, el trabajo eléctrico se convierte en calor que pasa
a aumentar la energía interna del foco. La inversión
del fenómeno sin que tengan lugar modificaciones en los
sistemas externos contradice el enunciado de Kelvin – Plank.
Es conveniente recalcar que al hablar de irreversibilidad de un
proceso queremos decir que es imposible que todos los sistemas
que han interaccionado puedan volver a sus estados iniciales sin
modificaciones en otros sistema s externos. Esta imposibilidad
implica que el proceso inverso no será posible espontáneamente.
Un proceso será reversible cuando tenga lugar a través
de una sucesión de estados de equilibrio (proceso cuasiestático)
y no existan efectos disipativos. En tales condiciones, el proceso
podrá invertirse volviendo los sistema sinteraccionantes
a la situación inicial sin otros cambios.çla aplicación
del enunciado de Kelvin – Plank a diferentes procesos conduce
a importantes resultados. Consideremos, por ejemplo, una reacción
química entre gases perfectos:
Que tenga lugar a presión y temperatura constantes (por
ejemplo, en contacto con la atmósfera). Partiendo de A
y B, la reacción avanza hasta que se alcanza la situación
de equilibrio químico. En estas condiciones cada gas ejerce
una presión parcial, Pk, idéntica a la que ejercería
el volumen de la mezcla si estuviera él solo a la temperatura
en cuestión. Si es Nk el número de moles del gas
k, la presión parcial será:

Y la presión total de todos los gases:

Dividiendo la ecuación (4) entre la ecuación (5)
resulta:

Donde xk es la fracción molar del gas k, definida por:

En la situación de equilibrio existe una relación
entre las fracciones molares, la presión y la temperatura,
que recibe el nombre de ley de acción de masas. Mediante
un ingenioso argumento debido a Van Hoff, el enunciado de Kelvin
– Plank conduce a esta relación.
Supongamos que existen membranas semipermeables que se comportan
de la siguiente forma: cuando dos gases se separan por una membrana
semipermeable a uno de ellos, tiene lugar un proceso de paso de
un gas a una u otra parte de la membrana hasta que se establece
un estado de equilibrio caracterizado porque las presiones parciales
a ambos lados de la membrana son idénticas. Por ejemplo,
el platino al rojo es una membrana semipermeable al hidrógeno.
Tomemos tres de tales membranas semipermeables para A, B y AB,
respectivamente y procedamos a obtener de forma reversible un
mol de AB a la presión P, a partir de un mol de A y un
mol de B a la presión P. En la figura adjunta viene esquematizado
el procedimiento.

Los pasos a seguir en el desarrollo del proceso son:
1º) Pasamos los gases A y B de la presión P a las
presiones PA y PB, respectivamente, mediante una compresión
reversible e isoterma. En esas condiciones, el trabajo realzado
será:

2º) A continuación, colocamos los gases A y B en contacto
con el sistema en equilibrio a través de paredes semipermeables.
Si introducimos los gases A y B manteniendo en todo momento constantes
las presiones PA y PB y sacamos gas AB a la presión parcial
PAB, habremos obtenido un mol de AB a partir de un mol de A y
un mol de B. El trabajo realizado en este caso será:
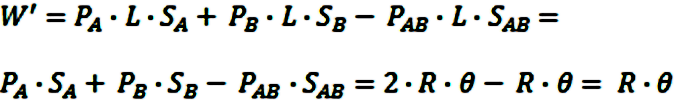
3º) Finalmente, pasamos de la presión PAB a la presión
P el mol de gas AB obtenido. El trabajo será:

El trabajo total desarrollado contando todos los pasos será:

Si invertimos el proceso utilizando un equilibrio con las presiones
parciales P’A, P’B y P’AB (alcanzado mediante
otra presión o a partir de distinta composición
inicial) el trabajo vendrá dado por:

De ese modo queda restablecida la situación inicial. El
trabajo total realizado en el ciclo, será:

Pero el enunciado de Kelvin – Plank exige que para todo
el ciclo el trabajo sea nulo. En consecuencia, se verificará:

Y pasando a fracciones molares, resulta finalmente:

Que es la expresión matemática del enunciado de
la ley d acción de masas, y donde la constante K depende
sólo de la temperatura que ha permanecido invariable durante
todo el proceso.
|
|
Otros usuarios de Matemáticas y poesía también
han visto:
|
|
|